李庆伟团队揭示一种来自七鳃鳗的新蛋白——LIP蛋白选择性杀伤肿瘤细胞的分子机制
辽宁师范大学七鳃鳗研究中心分别在2017年10月16日和2019年5月27日,在《Cell Communication and Signaling》在线发表了题为《A novel protein derived from lamprey supraneural body tissue with efficient cytocidal actions against tumor cells》和《Crystal structure of a cytocidal protein from lamprey and its mechanism of action in the selective killing of cancer cells》的研究成果。本研究从七鳃鳗神经轴体组织中成功分离纯化出一种新型免疫蛋白(LIP),该蛋白识别肿瘤细胞表面的磷脂酰丝氨酸(PS)诱发细胞焦亡和坏死,体内实验证明,LIP在不影响小鼠组织形态和体重的情况下能够抑制肿瘤的生长。由于LIP对肿瘤细胞具有特异性识别和杀伤某些肿瘤细胞的潜力,有望在医学和生物学领域得到应用。

早期研究表明,七鳃鳗神经轴体组织的细胞分泌物具有对肿瘤细胞的杀伤活性。为了鉴定发挥功能的蛋白质,使用羟基磷灰石柱和Q Sepharose Fast Flow柱对细胞分泌物进行纯化,通过对细胞膜的破坏现象来评估蛋白质活性是否存在。收集这些含活性蛋白质的洗脱液并通过12%SDS-PAGE分析和MALD I-TOF质谱确定纯化的蛋白分子量为34,086.457 Da,并将该蛋白命名为LIP。

图1. 从七鳃鳗神经轴体中鉴定到活性蛋白
LIP诱导肿瘤细胞的死亡典型的特征是在细胞表面形成球形囊泡状突起最后细胞解体。使用LDH分析检测LIP对杀伤肿瘤细胞的半致死量。LIP给药后12小时MCF-7、HepG2、K562和Jurket细胞的LD50值分别为:0.52 μg/mL,0.75 μg/mL,0.63 μg/mL,0.98 μg/mL。
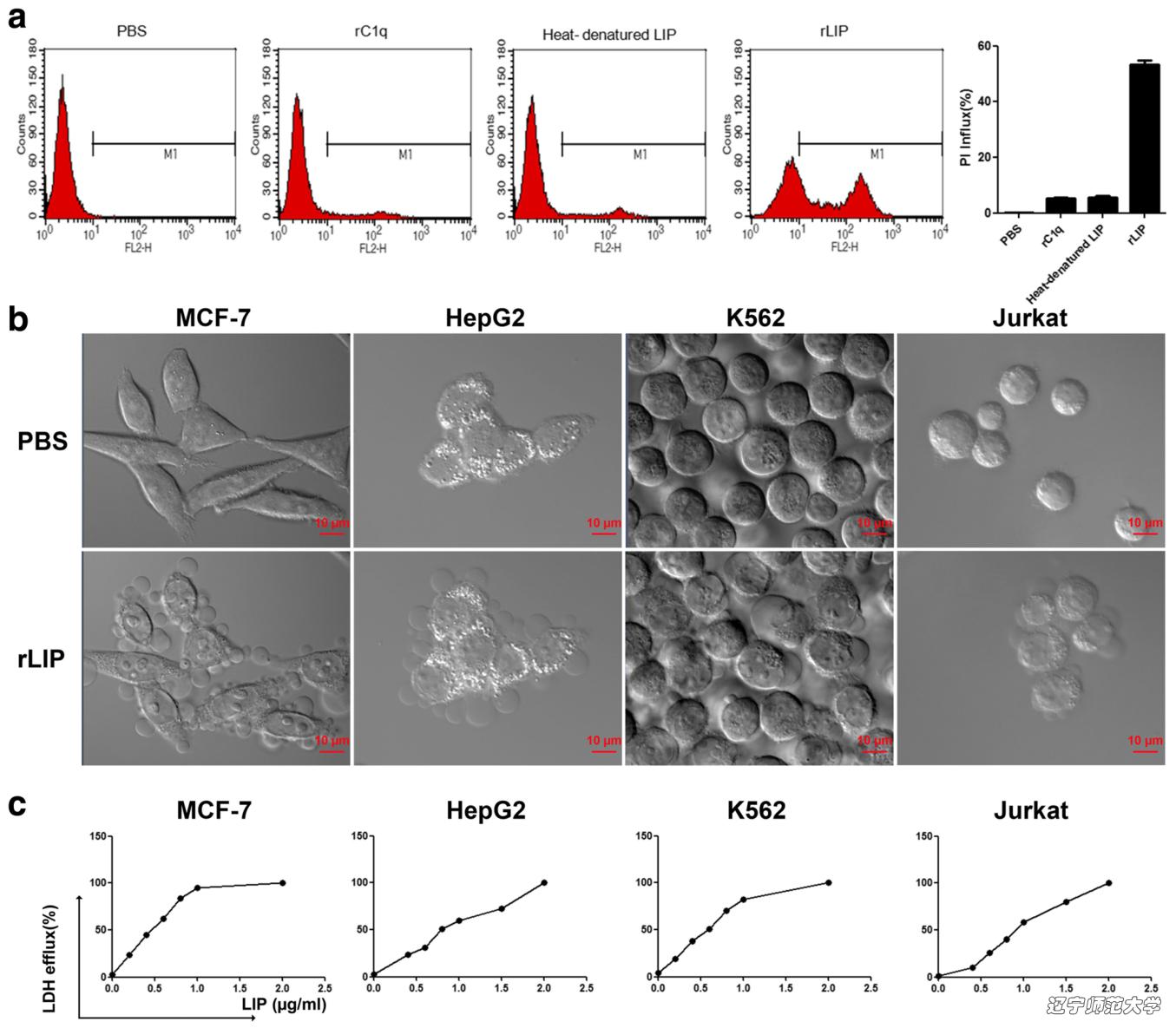
图2. 重组LIP的细胞杀伤活性
LIP主要作用于肿瘤细胞质膜上,能够破坏微管和线粒体的网状形态,使其片段化,而管状网络的内质网被转化为空泡特征。此外,LIP作用肿瘤细胞后,肿瘤细胞质中的甘油醛-3-磷酸脱氢酶(GAPDH),α-微管蛋白(α-tubulin),细胞色素C(Cytc)和蛋白质二硫键异构酶(PDI)释放到细胞外培养基中,说明LIP导致破坏肿瘤细胞膜结构。
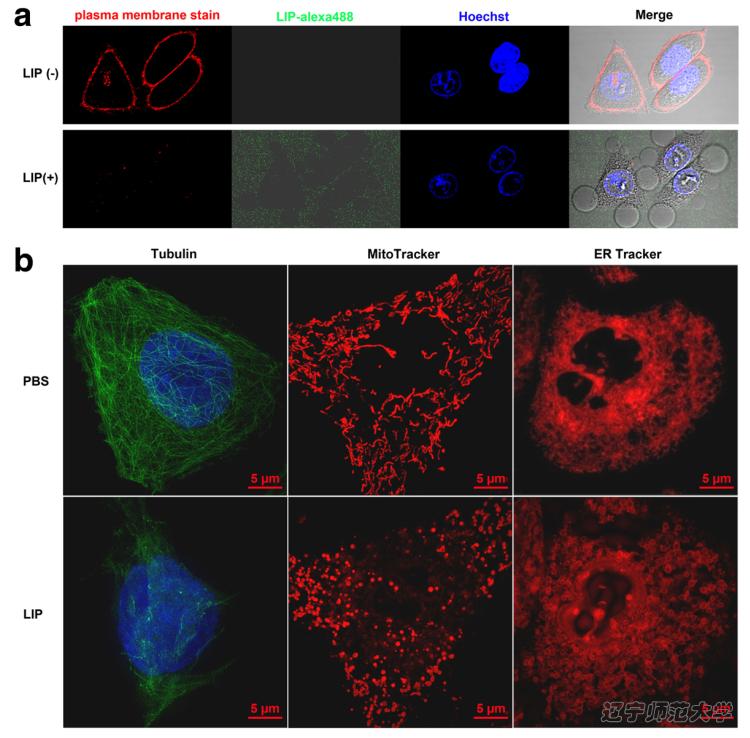

图3. 重组LIP对细胞形态学影响
为了评价LIP在体内发挥的抗肿瘤作用,成功建立小鼠MCF-7肿瘤模型。经过PBS注射的肿瘤小鼠瘤体积比LIP治疗组更大,肿瘤重量更高。与注射PBS的小鼠肿瘤细胞相比,LIP注射小鼠肿瘤部位导致肿瘤细胞发生凋亡,线粒体嵴结构被破坏。此外,大量LIP定位于肿瘤细胞上,同时募集小鼠体内巨噬细胞清除肿瘤细胞。实验结果证明,LIP具有在体内诱导肿瘤细胞死亡的能力积极作用。
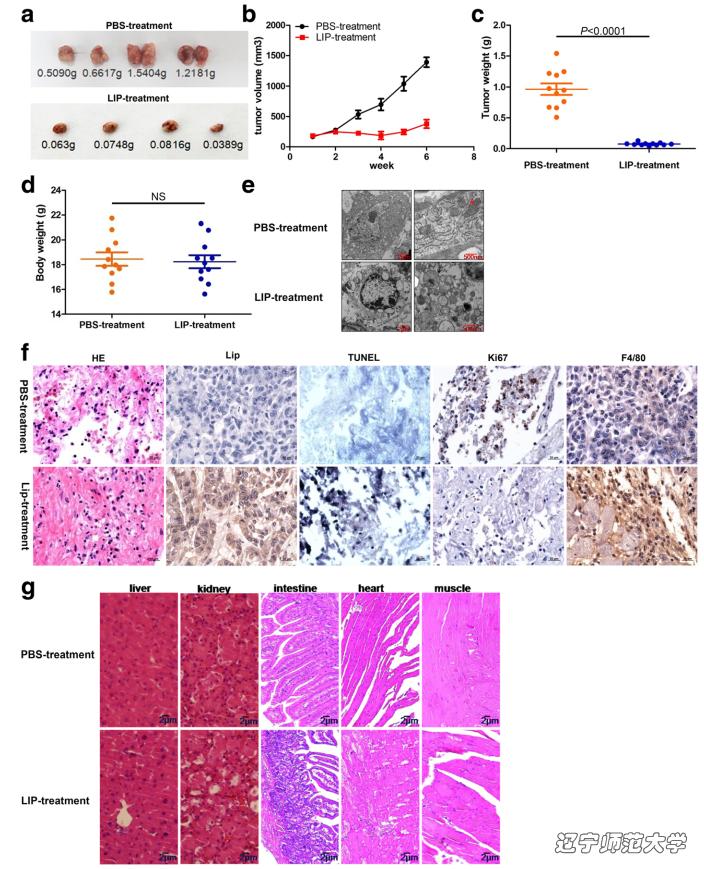
图4. 重组LIP对体内癌组织和正常组织的影响
在《Crystal structure of a cytocidal protein from lamprey and its mechanism of action in the selective killing of cancer cells》这篇文章中,对七鳃鳗免疫蛋白LIP选择性杀伤肿瘤细胞机制进行探究。

首先从细胞影像学入手,通过3D-SIM超高分辨荧光显微镜DeltaVision OMX成像,对LIP进行了定位研究。结果表明在癌细胞上LIP能够与质膜上的脂筏共定位,相反在正常细胞的质膜上却没有LIP的信号。

图5. 重组LIP与癌细胞膜脂筏共定位
利用ÄKTA蛋白纯化系统,采用Ni亲和层析和高分辨率分子筛层析柱,纯化出重组LIP,并通过晶体衍射解析出LIP的三维结构。结果表明,LIP是主要由β-折叠组成的三维结构,能通过中部的β-折叠插入到肿瘤细胞的质膜中。糖芯片筛查发现LIP能够特异性识别N025G与N003G糖型结构。利用Biacore T200直观的传感图与定量的亲和力大小可看出,二者确实能够与LIP结合,而且N003G与LIP结合要强于N025G。

图 6. Biacore检测LIP与N025 G/ N003 G结合
为了证明这一点,同时利用Biacore T200特有的分子垂钓功能,成功找到了LIP的受体。将LIP作为「诱饵」直接固定在CM5芯片上,以糖苷酶处理后的肿瘤细胞裂解液作为分析物,利用Biacore T200直接回收得到所有可能与LIP结合的分子,随后再通过质谱鉴定。质谱鉴定结果显示与糖芯片N003G十分相似的糖型特征,仅多一个岩藻糖修饰,而在对照的正常细胞的裂解液中并未发现类似的糖型结构。
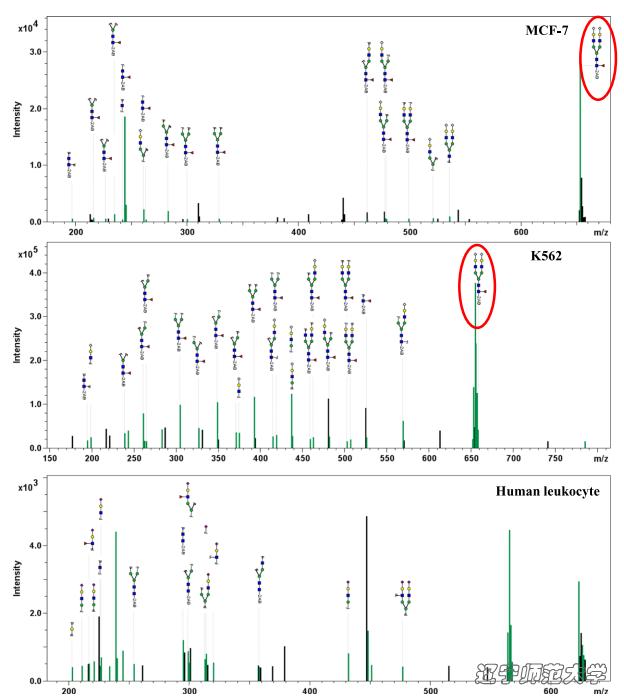
图 7. Biacore T200分子垂钓与MS/MS spectrum质谱鉴定结果验证肿瘤细胞表面关键受体
结合LIP的三维结构数据预测第135位的天冬氨酸可能比较关键Biacore T200的检测结果再次验证了这一假设。D135A突变的LIP蛋白完全不能结合N003G,充分证明D135A作为关键的氨基酸,介导了LIP与N003G的结合,并且这一结果与晶体结构数据完全一致。
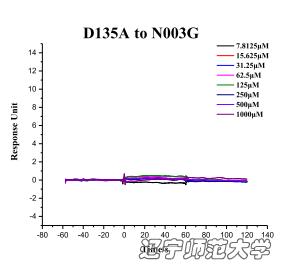
图8. Biacore T200结果显示当把LIP上关键的D135A位点突变以后,其与N003 G确实不结合
如果把肿瘤细胞用鞘磷脂水解酶SMase处理以后,LIP就会明显减弱其对肿瘤细胞杀伤的功效。使用Biacore T200对LIP与SM的结合进行验证,图9结果表明LIP与SM之间能够直接结合并且亲和力在10μM左右。
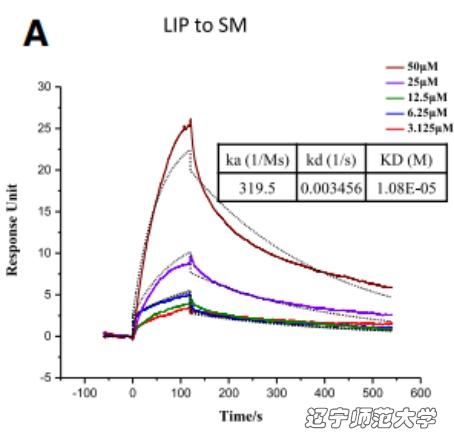
图 9. Biacore T200 验证LIP与鞘磷脂(SM)结合
两篇文章均为阐明LIP选择性杀伤肿瘤细胞的分子机制提供了关键数据。

